- أثار حدث نقل قلب خنزير لإنسان مريض بالقلب يوم 7 يناير 2022 جدلا واسعا بين الناس وأعاد تاريخا وقصصا ترجع لأكثر من قرن في مجال نقل الأعضاء بين الحيوانات المختلفة أو إلى الإنسان فيما يسمى ب Xenotransplantation. الحكاية ببساطة أن هذا الحدث هو استكمال لمجهودات فريق البحث الخاص بالدكتور محمد محيي الدين بمستشفى ميريلاند بالولايات المتحدة الأمريكية حيث كان يعمل في نقل الأعضاء بين الحيوانات الصغيرة في التسعينات من أواخر القرن العشرين. ظل فريق البحث يجري التجارب إلى أن تطور علم الجينات وأدوات الهندسة الوراثية في السنوات الأخيرة ونجحوا في انتاج خنازير معدلة وراثيا بحيث يمكن نقل أعضائها لقردة البابون. بعد توصيل قلب الخنزير المعدل وراثيا لقرد البابون ووضعه في التجويف البطني -أي نقل غير متجانس heterotopic transplantation- للقرد عاش هذا القلب مدة تصل إلى 945 يوم بدون الرفض المناعي لهذا العضو ثم تم رفضه بعدما أوقف فريق العمل الأدوية المثبطة للمناعة. تبع هذه المحاولة نقل قلب الخنزير لقرد البابون ووضعه مكان قلب قرد البابون -أي نقل متجانس orthotopic transplantation – وعاش هذا القل ينبض ويضخ الدم لأعضاء وأنسجة الجسم مدة تصل إلى 180 يوم. ثم جاءت المحاولة الأخيرة يوم 7 يناير بعد الحصول على موافقة استثنائية من هيئة الغذاء والدواء الأمريكية لإنقاذ حياة هذا المريض ولازال القلب ينبض داخله إلى اللحظة التي كتبت فيها هذا المقال ولا أحد يعلم ما إذا كان سيصل إلى نفس المدة التي عاشها القرد أم سيتعايش المريض بالقلب لأطول فترة ممكنة. الذي جعلني أكتب هذا الموضوع هو التعاون المنسجم مع علوم الطب والهندسة الوراثية بالإضافة للعلوم الأساسية لإنقاذ حياة البشر وهو الهدف الأسمى للعلوم جميعا. كي تتضح الأمور لابد من طرح أسئلة هامة وشرحها مبسطا.
1- كيف نحصل على أعضاء معدلة وراثيا؟ وما هي أدوات الهندسة الوراثية؟
- للحصول على أعضاء حيوانات معدلة وراثيا يمكن استهداف التالي (شكل 1):
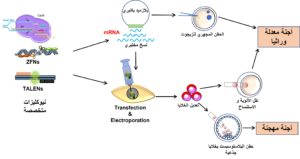
- تعديل الخلايا كاملة القدرات (Totipotent stem cells) وهذا إما بتعديل الحيوان المنوي، أو بتعديل البويضة، أو تعديل اللاقحة بالحقن المجهري أو حتى ادخال أو تعطيل الجينات في مرحلة الخليتين أو ما قبل مرحلة التوتية بواسطة (Transfection). وبهذا سينتج أجنة وحيوانات جميع أعضائها تحتوي على الصفات الجديدة المرغوبة (مثل إضافة جينoverexpression أو تعطيل جين gene knockout).
- يمكن استهداف الخلايا متعددة القدرات (pluripotent stem cells) وهذا بتعديل هذه الخلايا في المختبر ثم حقنها في مرحلة البلاستوسيست بالتالي ستندمج هذه الخلايا المعدلة وراثيا مع الكتلة الخلوية الداخلية (inner cell mass) وستشارك في تكوين أعضاء الجنين الذي سيصبح جنين هجين (Chimera). وحديثا تم حقن خلايا جذعية متعددة القدرات في بلاستوسيست من الخنزير فتم انتاج أجنة خنزير تحتوي على خلايا وأعضاء بشرية. إذا حدث وأن شاركت الخلايا المحقونة في تكوين الخلايا الجنسية (المبيض والخصية) ستتنقل الصفات المعدلة وراثيا للأجيال التالية بعد التزاوج مع حيوانات أخرى.
- يمكن تعديل الخلايا في المختبر (إما خلايا جذعية أو خلايا جسدية عادية) واستخدامها كخلية مانحة في عملية الاستنساخ أو نقل الأنوية (Somatic cell nuclear transfer) وبالتالي تدمج هذه الخلايا في البويضات منزوعة النواة ومن ثم ينتج أجنة معدلة ورثيا بالصفات المطلوبة. الميزة في استخدام هذه التقنية أنه يمكن اختبار الخلايا والتأكد من التعديل الوراثي المطلوب بتقنيات دقيقة واستخدام الخلايا المرغوبة بعد فصلها وفرزها (sorting) في عملية الاستنساخ.
- 2- لماذا الخنزير؟
- على الرغم من استخدام القردة والشمبانزي في أوائل المحاولات لنقل الأعضاء للبشر إلا أن النتائج الأولية باءت بالفشل لقوة الاستجابة المناعية في الإنسان أو لعدم مقدرة الأعضاء لملائمة الوظيفة المطلوبة بعد نقلها للإنسان. بعد الكشف عن جينوم الخنزير ونظرا لأن أعضاء الخنزير مقاربة لحجم أقرانها في الإنسان لجأ العلماء لتحوير الخنزير كي يكون خلاياه ملائمة لنقل الأعضاء. الخنزير يتمتع بصفات تقنية تجعله يفوق الحيوانات الأخرى في هذا المجال مثل سهولة تعديل الجينوم والطرق المستخدمة لذلك، يمكن للخنزير أن يحمل أكثر من 10 أجنة خلال فترة الحمل، قصر فترة الحمل نسبيا مقارنة بالقردة، وأخيرا قلة المعارضات الأخلاقية التي قد تسبب عائقا كبيرا مثل التعامل مع القردة والشمبانزي.
- 3- ما البدائل المتوفرة لنقل الأعضاء؟
- يبحث العلماء على جميع المستويات من الأدوية، العلاج الجيني، الخلايا الجذعية، أو حتى مستخلصات الخلايا الجذعية كالحويصلات الخارج خلوية (extracellular vesicles) مثل الإكسوزومات (exosomes). حديثا يتم استخدام الخلايا الجذعية وتمايزها لخلايا معينة لإنتاج أجزاء من الأعضاء أو طبقات من الأعضاء بتقنيه الطباعة ثلاثية الأبعاد (3D printers). إن الاهتمام بمثل هذه التقنيات يمكن أن يفيد في علاج الحالات المزمنة، ولكن إذا حدث تلف في الأعضاء بدوره يؤدي للوفاة -مثل القلب- سيحتاج الإنسان لاستبدال هذا العضو التالف ولذلك ستصبح الحيوانات المعدلة وراثيا مصدرا هاما ك “قطع غيار” لأعضاء الإنسان في الظروف الطارئة.
- نرجع للحدث الأهم الذي ظهر في مطلع عام 2020، ما الجينات التي تم تعديلها في هذا الخنزير بحيث يمكنها البقاء لمثل هذه الفترة في جسم القردة أو حتى الإنسان؟
- استهدف الفريق انتاج خلايا معدلة وراثيا بتعديل 10 جينات:
- 1- تعطيل جينات gene knockout لإزالة الصفة الأنتيجينية xenoantigen وتقليل الرفض المناعي لخلايا الخنزير مثل تعطيل الجينات المسؤولة عن تكوين البروتينات السكرية على غشاء الخلايا مثل GGTA1 – B4GalNT2 – CMAH وأيضا استهداف مستقبلات هرمون النمو في هذه الخلايا لمنع نمو خلايا القلب واستمرار نموه لحجم قد يضر الدورة الدموية للإنسان.
- 2- إضافة جينات بشرية human transgenes لخلايا الخنزير التي بدورها ستقلل الاستجابة المناعية (مثل hCD46 – hDAF)، تنظيم من عملية التجلط (مثل hTRBM – hEPCR)، وتنظيم الالتهاب المصاحب لنقل الأعضاء (مثل hCD47 – hHO1).
- ثم تم استخدام هذه الخلايا كخلايا مانحة في الاستنساخ والحصول على خنازير معدلة وراثيا.
- كل هذا المجهود بالإضافة لاستخدام كوكتيل من الأدوية الأخرى التي تقلل من المناعة وإنتاج الجسام المضادة والالتهابات في جسم الإنسان. ستشهد الأيام القادمة تطورا ملحوظا في نجاح هذه العملية وسيتعلم الباحثون دروسا في كيفية اختيار أو استهداف الجينات المطلوبة لسلامة نقل الأعضاء. لا شك أن التسابق في انتاج الحيوانات المعدلة وراثيا سيشهد تسارعا في السنوات القادمة للحصول على أكبر عدد من الحيوانات لتوافق الطلب المتزايد على نقل الأعضاء على مستوى العالم ولتقليل مافيا تجارة الأعضاء. ورأينا أن بعد هذه العملية بأيام أعلن بعض الباحثين في ألمانيا أن لديه خنازير معدلة وراثيا مستهدفة خمس جينات فقط وباحثون آخرون يستهدفوا جينات أخرى. لك أن تخيل إذا نجح العلماء في نقل رئة حيوان معدل وراثيا وزرعها مكان رئة مرضي الفشل الرئوي المصاحب لعدوى فيروس كورونا، حتما سيتم انقاذ ملايين البشر الذين لا يستطيعون التنفس جراء تلف خلايا الرئة بالفيروس. إن البحث العلمي ينظر في مسائل كثيرة على المستوى القريب والمستوى البعيد ولابد من تضافر كل الجهود لتوفير صحة جيدة لحياة البشر.
——————–
- الجينات المستهدفة ووظائفها:
|
الجين |
الاسم كاملا |
التعديل الوراثي في الخلايا |
وظيفته |
|
GGTA1 |
alpha-1,3-galactosyltransferase |
تعطيل Knockout |
تكوين البروتينات السكرية المكونة لصفة الغرابة xenoantigen |
|
B4GalNT2 |
Beta-1,4 N-acetylgalactosaminyltransferase 2 |
تعطيل Knockout |
|
|
CMAH |
cytidine monophosphate-N-acetylneuraminic acid hydroxylase |
تعطيل Knockout |
|
|
GHR |
Growth hormone receptor |
تعطيل Knockout |
تثبيط نمو خلايا الخنزير بعد نقلها |
|
hCD46 |
Membrane cofactor protein |
إضافة Human (h) transgene |
عوامل منظمة لتنشيط نظام المكمل Compliment system اللازم للاستجابة المناعية |
|
hDAF |
Complement decay-accelerating factor (CD55) |
إضافة Human (h) transgene |
|
|
hTRBM |
Thrombomodulin |
إضافة Human (h) transgene |
يقللوا من تكوين بروتين الثرومبين اللازم للتجلط |
|
hEPCR |
Endothelial protein C receptor |
إضافة Human (h) transgene |
|
|
hCD47 |
Leukocyte surface antigen CD47 |
إضافة Human (h) transgene |
تنظيم تنشيط الخلايا التائية T cells و السايتوكين و الالتهاب |
|
hHO1 |
Heme oxygenase 1 |
إضافة Human (h) transgene |
حماية الخلايا من الأكسدة و تنظيم الساتوكين و الالتهاب |