- استكمالا لما رأيناه من القدرات الهائلة للبويضة في الأجزاء السابقة (مقال 1 و مقال 2) و تحديدا في موضوع التوالد العذري parthenogenesis ففي يوم 7 مارس 2022 تم نشر بحث مؤخرا في مجلة “وقائع الأكاديمية الوطنية للعلوم” “Proceedings Of The National Academy Of Sciences, PNAS” عن توالد فئران بدون إخصاب. هذه ليست المرة الأولى التي يتم فيها ولادة فئران بدون إخصاب حيث تم توثيق حالات أخرى بعد استهداف بعض الجينات و العمليات الفسيولوجية المتحكمة في بصمة الجينوم أو ما يعرف ب Genomic imprinting و مرحلة الانتقال من الأم إلى اللاقحة (Maternal-to-zygotic transition) الذي سلطنا عليه الضوء في المقال 2 ( المقال 2).
- بصمة الجينوم هي ظاهرة فوق جينية Epigenetic تؤدي إلى تنشيط أو تثبيط عمل الجينات، اعتمادًا على ما إذا كانت موروثة من الأم أو الأب. يمكن أيضًا طبع أو بصمة الجينات جزئيًا عندما يتم التعبير عن الأليلات من كلا الوالدين بشكل مختلف بدلاً من التعبير الكامل أو الإسكات silencing الكامل لأليل أحد الوالدين.
- للتبسيط: في الكائنات ثنائية الصبغي Diploid (مثل البشر)، تمتلك الخلايا الجسدية نسختين من الجينوم، واحدة موروثة من الأب والأخرى من الأم. لذلك يتم تمثيل كل جين جسمي autosomal gene بنسختين، أو أليلات alleles، مع نسخة واحدة موروثة من كل من الأب والأم عند الإخصاب. والأليل المعبر عنه يعتمد على أصله الأبوي. على سبيل المثال، يتم التعبير عن الجين المشفر لعامل النمو الشبيه بالأنسولين 2 (IGF2 / Igf2) فقط من الأليل الموروث من الأب.
- على النقيض يوجد أكثر من طريقة لإنتاج أجنة بدون اشتراك الحيوان المنوي وأكثرهم شيوعا هو تنشيط البويضة بعد الانقسام الميوزي الأول مباشرة إما باستخدام مواد تمنع تفرق الكروموسومات حتى ينتج أجنة diploid ولكن اذا لم تستخدم هذه المواد سوف يكون أجنة أحادية الصبغي Haploid. إذا نظرنا في هذه الطريقة للتوالد العذري سنجد أن جينات الأم فقط متواجدة بصفة متضاعفة وبالتالي البصمة الجينية ستؤدي إلى موت الأجنة مبكرا حيث إذا تم نقل الأجنة المنشطة كهربيا أو كيميائيا للأم الحاضنة سوف تحمل الأمهات بأجنة غالبا لا تستمر في الحمل لأكثر من نصف فترة الحمل كما أثبتنا هذه الحالة في حمل أجنة الكلاب المنشطة كيميائيا وتم إجهاض هذه الأجنة في اليوم 31 من الحمل أي في منتصف فترة الحمل نتيجة خلل في تعبيرات الجينات في هذه الأجنة. وتم تجربة مثل هذه الطريقة في الأغنام والفئران والخنازير وحصل الباحثون على نفس النتائج حيث يحدث اضطراب في التعبيرات الجينية المسؤول عن موت الخلايا المبرمج Programmed cell death or Apoptosis.
- لهذا مع الفهم الدقيق لهذه العمليات وكيف يتم تنشيط أو تعطيل الجينات وجد العلماء سبعة مواضع يتحكموا في المثيلة methylation و إزالة المثيلة demethylation التي بدورها تتحكم في تنشيط أو تثبيط الجينوم و سميت هذه العوامل ب “مناطق التحكم في البصمة” (Imprinting control regions) و اختصارا ICR. تشمل هذه العوامل H19 و Gtl2 و Igf2r و Snrpn و Kcnq1ot1 و Nespas و Peg10 الذين يلعبون دورا محوريا في تنظيم نمو الجنين لحين الولادة.
- في أوائل المحاولات للحصول على مواليد عن طريق التوالد العذري عام 2004 قام الباحثون باستخدام بويضات تفتقر إلى جين H19 مع نقل نواة بويضة ناضجة لهذه البويضة بالتالي تحتوي البويضة المعاد تركيبها على نسختين من الأم ثم تم تنشيطها كيميائيا ونقلها لأم حاضنة. تم ولادة 28 فأرا من أصل 457 بويضة استخدمت وعاشت فأرتان منهم واحدة وصلت إلى مرحلة البلوغ “اسمها كاجويا” و تزاوجت وولدت فئران طبيعية.
- في عام 2009 قام الباحثون بالدمج الكهربي لخلايا الأجنة المنشطة كيميائيا في مرحلة الخليتين لتصبح رباعية الصبغيات Tetraploid و بعد تكوين مرحلة البلاستوسيست تم حقنها بخلايا جذعية مشتقة من الأجنة المكونة من التنشيط الكيميائي مسبقا و تم الحصول على أجنة هجينة Chimera بدون اشتراك الأب في هذه العملية حيث ساعدت الخلايا رباعية الصبغي في حدوث و إكمال الحمل و الولادة.
- وفي عام 2018 و بتطوير و تحوير الدراستين السابقتين تم ولادة فئران بعد تحوير الخلايا الجذعية المشتقة من أجنة التوالد العذري أحادية الصبغي Haploid و تعطيل بعض مناطق ICR في هذه الخلايا ومن ثم حقنها في بويضات ناضجة بدلا من الحيوان المنوي و تم الحصول على أجنة و مواليد من هذه التقنية.
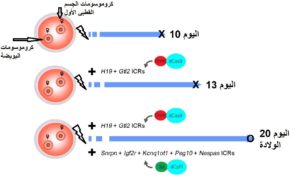
- أما في عام 2022 قام الباحثون في الدراسة التي نحن بصدد التحدث عنها باستهداف مثيلة مناطق ICR السبعة باستخدام تقنية كرسبر Crispr/Cas9 على مستوى البويضات الغير مخصبة وذلك لاستهداف السبعة جينات على مستوى متخصص ومتقدم من استهداف الأليلات بحيث يتم مثيلة H19 و Gtl2 في أليل واحد بينما استهدف الخمسة الأخرون في الأليل الآخر (شكل رقم 1). للحصول على أجنة ثنائية الصبغي تم دمج الجسم القطبي الأول مع نواة نفس البويضة للحصول ثم تنشيطها كيميائيا و من ثم تم الحصول على أجنة قادرة على إكمال فترة الحمل و الولادة عن طريق التوالد العذري من بويضات غير مخصبة.
- لا شك أن الجينات والأليلات يحدث بينهم تفاعلات هيمنة وسيادة ليثبت كل جين وجوده ولهذا فإن التنسيق الدقيق بين جينوم الأب والأم هام جدا للتطور الجنيني في الثدييات وحدوث أي خلل في هذه العملية حتما سيؤدي إلى أمراض مثل متلازمة أنجلمان Angelman syndrome ومتلازمة برادر–ويلي Prader–Willi syndrome وحتى يسبب العقم عند الذكور أو إلى الموت الجنيني المبكر.
-
الأليل وظيفته H19 يقع هذا الجين في منطقة مطبوعة من الكروموسوم 11 بالقرب من جين عامل النمو الشبيه بالأنسولين 2 (IGF2). يتم التعبير عن هذا الجين فقط من الكروموسوم الموروث من الأم وبالتالي يتم اسكاته silencing في الكروموسومات الأبوية، في حين يتم التعبير عن IGF2 فقط من الكروموسوم الموروث من الأب. منتج هذا الجين هو RNA طويل غير مشفر long non-coding RNA ويعمل كمثبط للأورام. Gtl2 هذا الجين هو جين مطبوع من قبل الأم يقع في الكروموسوم 14 وينتج long non-coding RNA ويعمل كمثبط للأورام ومحفز لتكوين الأوعية الدموية. Igf2r يقوم هذا الجين بتشكيل مستقبلات عامل النمو الشبيه بالأنسولين 2 Insulin-like growth factor 2)) وهو من الجينات المطبوعة من قبل الأم Snrpn يقع هذا الجين في الكروموسوم 15 ويتم طبعه والتعبير عنه من الأليل الأبوي. يشكل هذا الجين بروتين معقد مكونًا من بروتين نووي صغير small nuclear ribonucleoprotein Kcnq1ot1 هو أليل معبر عنه من قبل الأب ويتواجد بالقرب من النوية وينتج long non-coding RNA لتنظيم التعبيرات الجينية و الفوق جينية Nespas له اسم آخر هو GNAS antisense RNA 1 هو أليل معبر عنه من قبل الأب وينتج long non-coding RNA الذي ينظم البروتين المعقد GNAS الذي يشكل الوحدة الفرعية ألفا لبروتين G التحفيزي stimulatory G protein Peg10 جين مطبوع يتم التعبير عنه من قبل الأب. يحدث التعبير الأكثر بروزًا في المشيمة ويلعب دورًا في تكاثر وتمايز الخلايا وأيضا الموت المبرمج للخلايا. زيادة التعبير عن هذا الجين ترتبط بالعديد من الأورام الخبيثة، مثل سرطان الخلايا الكبدية وسرطان الدم الليمفاوي للخلايا البائية. الفئران التي تفتقر إلى هذا الجين knockout تموت في مرحلة مبكرة من التطور الجنيني مصحوبة بعيوب في المشيمة، مما يشير إلى أهمية هذا الجين في التطور الجنيني.

