خلال الثلاثة أو الأربعة عقود الماضية تَغَيَّرَ مفهوم علاج السرطان من عقاقير قاتلة للخلايا لكنها غير متخصصة تهاجم كل الخلايا سريعة الانقسام، إلى علاجات متخصصة تهاجم خلايا السرطان فقط، قائمة على آلية عمل محددة، أو ما يُسمّى العلاجات المستهدِفة للسرطان ( targeted-cancer therapy ). هذا النوع من العلاج يوقف نمو وانتشار السرطان عن طريق التعرض لبعض الأهداف الحيوية التي لها دور مهم في تكاثر الخلايا السرطانية. وتعتبر إنزيمات البروتين كينيز أحد أهم هذه الأهداف الحيوية التي يمكن استهدافها لمعالجة السرطان. أَوّلُ مثبطات الكينيز – المستخدمة لعلاج السرطان – إِجازةً للاستخدام كان في عام 2001، وتتابع اكتشاف مثبطات الكينيز بوتيرة سريعة حتى وصلت في يناير 2022 إلى 70 دواءا مُجازا من هيئة الغذاء والدواء لعلاج أمراض مختلفة، أكثرها لعلاج السرطان. وهذا عدد هائل جدا من الأدوية التي تستهدف نوعا معينا من الإنزيمات.
وإنزيمات البروتين كينيز ( protein kinase ) تقوم بفسفرة أو فسفتة ( phosphorylation ) بعض البروتينات، أي إضافة مجموعة فوسفات إليها. حيث تعمل هذه الإنزيمات كوسط ومحفّز للتفاعل، وذلك بتهيئة الظروف المناسبة لإتمام نقل مجموعة الفوسفات الطرفية من جزيء أدينوسين ثلاثي الفوسفات ( ATP ) إلى البروتين، تحديدا هي عملية أستره ( esterification ) لمجموعة الكحول أو الفينول في أيٍّ مِن هذه الأحماض الأمينية: السِّيرين، الثِّرْيُونين، و التَّيروزين.

شكل يوضح انتقال مجموعة الفوسفات من جزيء أدينوسين ثلاثي الفوسفات إلى البروتين
- وينتج عن عملية الفسفرة تغير في خصائص البروتين المفسفر ( phosphorylated protein ) وفي شكله الفراغي، يستتبع هذا التغير قيامُ هذه البروتينات المفسفرة بكثير من الوظائف الحيوية مثل انقسام الخلايا، نقل الإشارات الخلوية، نمو الخلايا، تصنيع البروتين، الموت الخلوي المبرمج ( apoptosis )، وغيرها من العمليات الحيوية الهامة جدا في الخلية، لدرجة أنه يمكن القول بأن إنزيمات البروتين كينيز مسؤولة عن تنظيم معظم العمليات الحيوية في الخلية. وبالتالي فإنَّ الخلل في وظيفة بعض إنزيمات البروتين كينيز سوف يستتبعه خلل في وظائف الخلية قد يؤدي إلى بعض الأمراض مثل السرطان، أمراض الالتهاب، بعض أمراض الجهاز العصبي والجهاز الدوري وغيرها.
- لابد أن يحتوي إنزيم الكينيز على مكان يستوعب جزيء أدينوسين ثلاثي الفوسفات ومكان آخر يستوعب الجزء من الببتيد الذي سيُنقل إليه مجموعة الفوسفات، وأن يكون مسرح الأحداث أو الموضع النشط في الإنزيم ( active site ) ملائما لهذه العملية الحفزية. هذه الملائمة تشمل الملائمة الفراغية والإلكترونية. وأعني بالتهيئة أو الملائمة الفراغية وجود المتفاعلات (وهي كل من جزيء أدينوسين ثلاثي الفوسفات والببتيد) في الوضع الملائم لنقل مجموعة الفوسفات، أما التهيئة الالكترونية فتعني وجود مجموعات وعناصر كيميائية في الموضع النشط للإنزيم تُسَهِّل عملية الفسفرة. ولقد درس العلماء كثيرا من إنزيمات البروتين كينيز ووجدوا تشابها كبيرا في الموضع النشط لها. وربما كان من أوفرها نصيبا بالدراسة إنزيم ( cAMP-dependent protein kinase ) أو ( Protein Kinase A ) واختصارا ال ( PKA )، والذي سنعرضه كمثال. يحتوي الموضع النشط لهذا الإنزيم على بعض الأحماض الأمينية والأيونات الضرورية لإتمام عملية فسفرة البروتين. فالحمض الأميني أسبارتيك رقم 184 ( Asp-184 ) يرتبط بأيون الماغنسيوم الذي يرتبط بدوره مع مجموعتي الفوسفات بيتا وجاما في جزيء ( ATP )، هذا الارتباط بأيون الماغنسيوم ربما يضع مجموعة الفوسفات الطرفية ( جام ا) في الموضع المناسب للتفاعل مع مجموعة الهيدروكسيل في جزيء البيبتيد، وربما يُقَلّلُ تركيزَ الشحنة السالبة على مجوعات الفوسفات الطرفية بحيث لا تتنافر مع النيوكليوفيل الوافد، ولا يُعْرَفُ أيُّ الدورين أهم، ولعلّهما في الأهمية سواء. وعلى كل حال فإنّ دور ( Asp-184 ) في غاية الأهمية في العملية الحفزية لانتقال مجموعة الفوسفات. من الأحماض الأمينية الهامة أيضا في موضع الإنزيم النشط حمض اللّيسين رقم 72 ( Lys-72 ) والذي يُعطي ثباتا إضافيا لمجموعتي الفوسفات ألفا وبيتا من خلال ارتباطه بهما، ومن ثَمَّ يساعد أيضا في وضع مجموعة الفوسفات الطرفية ( جاما ) في الموضع المناسب. وأخيرا فإن الحمض الأميني أسبارتيك رقم 166 ( Asp-166 ) يوجد في موضع قريب من مجموعة الهيدروكسيل ( النيوكليوفيل ) ويرتبط معها برابطة هيدروجينية ويُوجّهُهَا لتهاجم مجموعة الفوسفات الطرفية في جزيء ( ATP ).
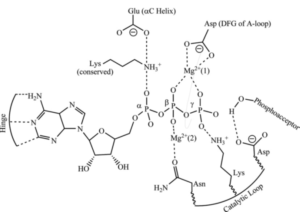
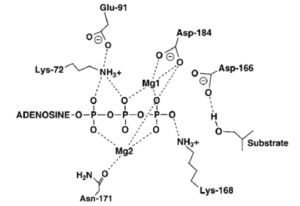
- مخططان يوضحان الموضع النشط في إنزيم ال ( PKA )
- قد تبدو عملية نقل مجموعة الفوسفات من جزيء أدينوسين ثلاثي الفوسفات إلى البروتين سهلة ومباشرة، فهو تفاعل إبدال نيوكليوفيلي ( nucleophilic substitution reaction )، لكنّ العلماء في الحقيقة بذلوا جهدا كبيرا لوضع تفسير أو تصور للآلية التي تتم بها هذه العملية. وهذا ما سنعرضه في المقال القادم بإذن الله تعالى فانتظرونا ياكرام.
د. أحمد زكريا عبدالعظيم
مدرس بكلية الدراسات العليا – جامعة بني سويف
باحث زائر لأبحاث ما بعد الدكتوراه – جامعة هانيانج – كوريا الجنوبية ( 2017-2018 )
دكتوراه الكيمياء البيولوجية – جامعة العلوم والتكنولوجيا – كوريا الجنوبية ( 2011-2015 )
بكالوريوس الصيدلة ( 2002 ) وماجستير الكيمياء الصيدلية ( 2009 ) – كلية الصيدلة جامعة أسيوط
البريد الالكتروني : ( aznagi@psas.bsu.edu.eg )

